吉利德出手210亿美元押注癌症ADC疗法,靶向化疗时代到来?
吉利德科学(Gilead Sciences)成为今年制药行业的大明星。
他们先是凭借新冠肺炎 “疑似特效药” 瑞德西韦收获了全世界的关注,接着在今年 9 月中旬,吉利德宣布了本年度制药行业最大的一笔收购:210 亿美元收购 Immunomedics。这是一家专注于抗体偶联药物(Antibody Drug Conjugate,简称 ADC)研发的美国企业。
这笔巨资收购的背景值得玩味。
豪掷 210 亿美元的背后
吉利德曾经专注于艾滋病和丙肝治疗,但随着专利到期、仿制药竞争,这两大业务无法支撑公司持续增长。从 2017 年开始,公司转型,大举进入癌症治疗领域,一系列的并购投资彰显了吉利德押注癌症治疗业务的决心。
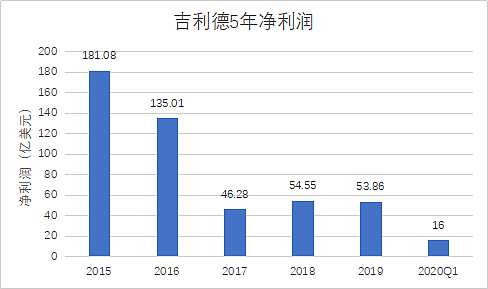
图|吉利德近五年净利润呈下降趋势
三年,五次出手。这次收购吉利德豪掷 210 亿美元,基本花光了公司持有的全部现金。资料显示,截止 2019 年底,吉利德公司账户现金达 243.5 亿美元。为了顺利完成交易,公司动用了现金账户中的 150 亿,外加债券融资 60 亿。

表|吉利德进军癌症治疗领域 (来源:公开资料)
很明显,在吉利德看来,这次“抓了一条大鱼”。吉利德凭什么看中 Immunomedics?后者手里抓了一手什么样的王牌,值得吉利德做出近乎孤注一掷的如此举动?
Immunomedics 成立于 1982 年,致力于抗体药物和 ADC 的研发。但是在 2020 年之前,它没有一款新药上市。直到 2020 年 4 月,公司的沙伊图珠单抗(Sacituzumab govitecan,药名为 Trodelvy)获美国食品药品监督管理局(FDA)加速批准,成为全球首个治疗三阴性乳腺癌的抗体偶联药物。不止于此,Trodelvy 也成为首个针对 Trop-2 靶点的靶向药物。
Immunomedics 是 38 年磨一剑,吉利德更是 210 亿美元掷一注。
对此,药明生物执行董事、执行副总裁兼首席技术官周伟昌博士告诉 DeepTech:“已有临床数据显示,Trop-2 是一个很重要的靶点,除了在三阴性乳腺癌,该靶点在多种实体瘤中均有表达。”
这意味着吉利德看似买了一款药,其实未来可能治疗多种癌症。公开资料显示,Trop-2 在各种人类上皮性肿瘤中表达更高,包括乳腺癌、肺癌、胃癌、结肠直肠癌、胰腺癌、宫颈癌和卵巢癌等,或者这才是吉利德愿意出高价的真正原因。
Trodelvy 作为 Immunomedics 的拳头产品,三期临床疗效显著,以无进展生存期(PFS)指标来看,接受该药物治疗的患者 PFS 中位数为 5.6 个月;与之对比,接受化疗的患者为 1.7 个月。
PFS 指的是“患者在治疗某种疾病或治疗后的时间内,患者与疾病共存,但是疾病不会恶化的持续时间”,该指标用以判断药物治疗肿瘤方面的疗效。PFS 从 1.7 个月增加到 5.6 个月,差距已经足够显著。
当前,全球已经有 9 款 ADC 药物上市,其中 6 款是近两年上市的。根据美国市场调研公司 Grand View Research 预测,到 2025 年,全球 ADC 市场规模将达到 99.3 亿美元,未来 5 年将保持 25.9% 的年复合增速。
浙江新码生物医药公司(下称新码生物)董事长梁学军对 DeepTech 表示,ADC 的一大优势就是可以批量、工业化生产,从而降低了治疗费用,“未来使用 ADC 治疗癌症,每年费用可以控制在 20 万人民币左右。”这和当前火热的另一种癌症治疗方法 CAR-T 疗法相比有明显优势:CAR-T 疗法由于需要定制,价格昂贵,查询公开资料得知,全球第一款上市的 CAR-T 药物、来自诺华公司的 Kymriah,一次性治疗费用需 47.5 万美元。
ADC 由三部分组成,单克隆抗体、毒素分子和用于连接它们的连接子(Linker)。
当 ADC 注入人体后,其杀死癌细胞的过程可分为 3 步。
第一步,利用单克隆抗体靶向性,找到癌细胞,ADC 与靶癌细胞结合。
第二步,癌细胞通过内吞作用,把 ADC“吃到肚子里”。
第三部,ADC 分子被癌细胞溶酶体溶解,毒素分子释放,癌细胞被杀死。
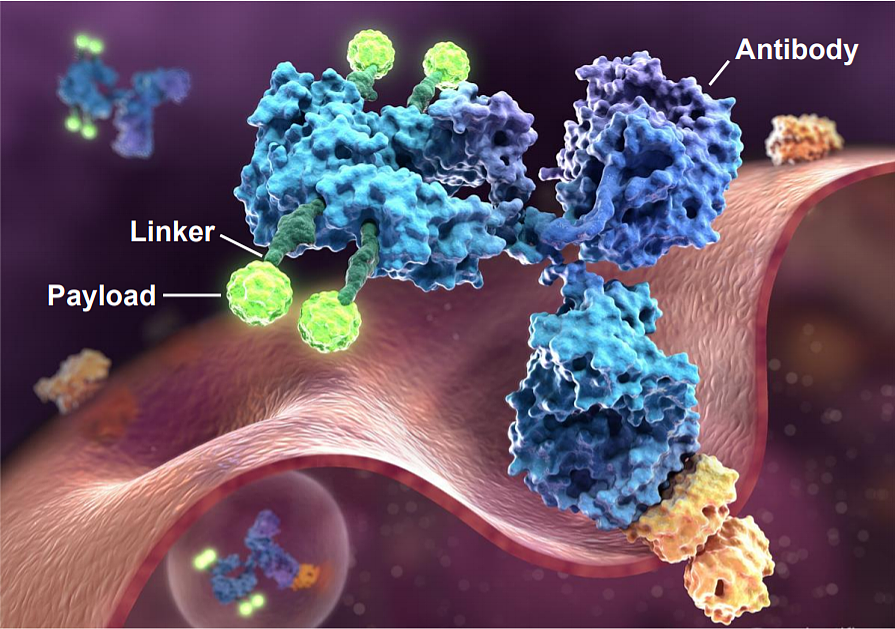
图|ADC 药物分子示意图
ADC 药物有点像是拼凑起来的变形金刚。毒素分子来源于癌症化学疗法,而单克隆抗体要追溯到上个世纪 70 年代。ADC 的诞生是医学多种子领域共同进步的结果。
用 100 年寻找“神奇子弹”
哈佛大学丹纳 - 法伯癌症研究所(Dana-Farber Cancer Institute)是全球知名的癌症研究中心之一,该机构的名字是为了纪念现代化疗之父——西德尼 · 法伯(Sidney Farber)。
1947 年底,受叶酸促进癌细胞增殖的启发,法伯反其道行之,通过给白血病患者注射叶酸拮抗剂(抑制叶酸活性),16 名患者中有 10 名病症得到了暂时缓解。此后,经过一系列实验,法伯开创了癌症的现代化学疗法。
所谓癌症化疗,就是用能杀死癌细胞的化学毒素来治疗癌症。在化疗诞生之初,医学还没有揭示癌症的深层次成因,肿瘤医生和化学家只能通过大量实验,去寻找那些能够杀死癌细胞的化学物质。从 1954 到 1964 年,美国癌症化学疗法国民服务中心(CCCNSC)测试了 8.27 万种化学合成试剂、11.5 万种发酵产品和 1.72 万种植物衍生物,每年对 100 万只小鼠开展各种化学实验,就是为了找到一种理想的杀死癌细胞的药物。
但每一种化疗药物,都逃脱不了 “杀敌一千,自损八百” 的魔咒。细胞毒素在杀死癌细胞的同时,也会杀死健康细胞和人体免疫系统,化疗到最后往往成为了 “人和癌症谁先死亡” 的竞赛。
上世纪 80 年代,正是癌症化学疗法大发展时期。化疗师们尝试各种化学毒素的排列组合,越来越多的药物进入临床试验,越来越强的副作用随之而来。时任国家癌症咨询委员会成员的罗丝 · 库什纳写道:“当医生说副作用是可忍受或可接受的时候,他们其实是在谈论可危及生命的东西。就算你呕吐到眼睛血管爆裂…… 他们也认为不值一提。”
肿瘤医生面对病人更是两难抉择:一边是没有把握的新药物组合(副作用),一边是无可逃避的死亡。寻找只会杀死癌细胞,而不会损伤健康细胞的化学药物,仿佛是一个幻想。
但科学家的这种努力从未停止过。
早在 1900 年,德国诺贝尔奖获得者保罗 • 埃利希 (Paul Ehrlich) 提出了 “神奇子弹” 的概念:让有毒的分子注入人体,攻击癌症细胞而不损伤周围的健康细胞。“神奇子弹”的提出要早于现代化学疗法的诞生。
化疗药物是一种子弹,为这颗子弹嵌入“神奇”,则要追溯到 1975 年。
这一年,乔治 · 科勒(Georges Kohler)等人设计了杂交瘤技术,产生了一种特殊的抗体。这种抗体由单一 B 细胞克隆产生,高度均一,且只针对某一种特定的抗原起作用,称为单克隆抗体。
单克隆抗体由于具有靶向性,很快被应用于癌症治疗。单克隆抗体治疗某些特定癌症的机理是,通过与癌细胞特异性结合,减缓、阻断其增殖,或者介导免疫细胞杀死癌细胞。
另一种技术路线则是,对单克隆抗体进行修饰,让它携带细胞毒素,精准找到癌细胞,释放毒素杀死后者。这就是抗体偶联药物(ADC),也是保罗 • 埃利希设想的“神奇子弹”。
2000 年,由辉瑞 / 惠氏研发的 ADC 药物 Mylotarg 获得美国 FDA 批准上市,虽然迟到了 100 年,后又因安全问题退市,但是首个 ADC 药物的诞生给癌症治疗带来了新曙光。
简单地理解,癌症 ADC 疗法,就是靶向化疗。
创新性靶点:新希望、高风险、高收益
周伟昌说,和传统单克隆抗体药物相比,ADC 的研发和生产要复杂许多倍。ADC 药物由单克隆抗体、毒素分子和连接子组成,将这三部分组合起来并不容易。单克隆抗体属于生物药,毒素属于小分子药物。想要做 ADC,企业必须能同时生产抗体、毒素和连接子,也要有足够的资金实力。早在 1997 年,全球第一个单克隆抗体利妥昔单抗(Rituximab)就上市了。而第一个 ADC 药物(Mylotarg)在 2000 年才上市,并且因为安全性问题在 2010 年退市,2017 年再次上市。
ADC 研发难点在于,要将靶向(单克隆抗体)和化疗(细胞毒素)用连接子稳定连接起来。周伟昌介绍,一个好的连接子,要满足两个条件。
第一个条件是:它既要稳定,又要不稳定,找到两者之间的平衡点需要开展大量研究。稳定是说连接子在血液中无法被分解,否则连接子提前断裂,毒素在到达目的地之前被释放,就会杀死健康细胞;而当 ADC 进入癌细胞之后,连接子要能正常分解,从而释放毒素杀死癌细胞。
第二个条件,是尽量保证每个单克隆抗体连接的毒素分子一样多。这一点恰恰是非常难做到的事,涉及到分子层面的操控。一般来说,毒素分子是通过双硫键连接到抗体身上,如果每个抗体连接的毒素分子数量不一致,则很可能同一批药物,病人有时候产生较大的副作用(毒素溢出癌细胞),有时候没有效果(毒素太少)。
在这一点上,新码生物采用了不同于双硫键的偶联技术。梁学军介绍,他们使用非天然氨基酸连接抗体,再将毒素分子连接到非天然氨基酸上,这样做的好处是毒素分子连接稳定,数量可以精确控制。
去年底,新码生物公布了其 ADC 在研产品 ARX788 的一期临床数据。数据显示,ARX788 在晚期 HER2 阳性乳腺癌患者中,表现出很高的响应率,而且同时几乎没有产生类似其他 ADC 类产品的血液毒性。梁学军认为,这得益于新型偶联方式的稳定性。
当前,国内进展较快的 ADC 药物是百奥泰的 BAT8001,已进入临床三期。资料显示,BAT8001 使用了自主研发的连接子,毒素分子则采用美登素(maytansine)。作为国内首个进入临床三期的 ADC 药物,BAT8001 预计 2021 年完成临床工作并申报中国 NDA(新药申请)。
根据数据统计,截止到 2020 年 9 月,如果计算国外药企的 ADC 产品在中国进行临床试验的情况,全球进入临床阶段的 ADC 药物,美国有 66 个,中国有 14 个。其中,已经上市的 ADC 药物,美国有 9 个,中国仅有 2 个(罗氏集团的 Kadcyla 于 2020 年 1 月获批和武田制药的注射用维布妥昔单抗,于 2020 年 5 月获批)。
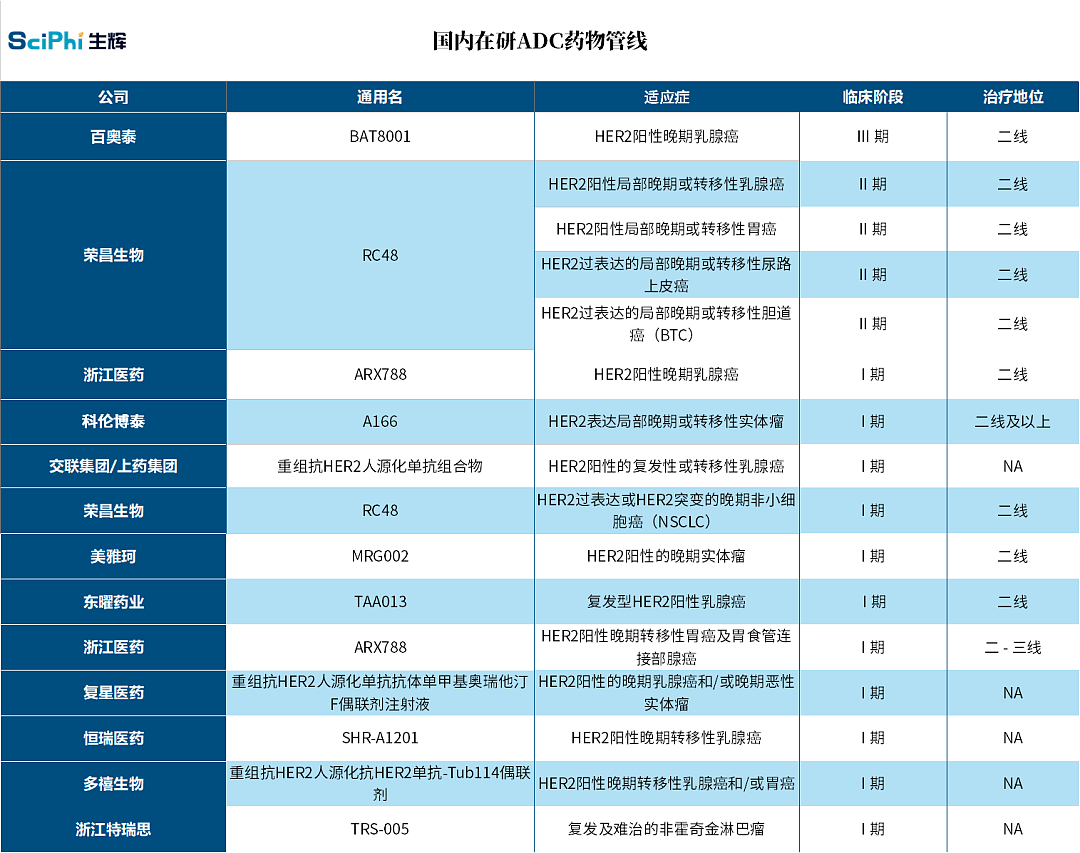
图|国内在研 ADC 药物一览 (来源:生辉)
从上图中可以看到,当前国内 ADC 产品均以 HER2 为靶点研发。HER2 是抗体药物研发中最经典的靶点之一。作为老靶点,针对它的单克隆抗体研发技术已经成熟,技术也经过多次迭代,开发难度较低。国内企业选择以 HER2 为靶点发开 ADC 药物,主要考量是风险 - 收益权衡。
而这次被吉利德看中的 Trodelvy,是第一款针对 Trop-2 为靶点的靶向药物——它被称为创新性靶点(Innovative Target)。
为什么 Immunomedics 可以卖到 210 亿美元?这与靶点的价值直接相关。
国外专门研究药物研发的机构 Tufts Center 曾经给出了一组数据,展示了开发一款新药的成本到底有多高。数据显示,药物开发周期从临床前靶点筛选到最终上市,平均至少 13.5 年(不包括靶点确认阶段),其中临床前要 5.5 年,临床开发要 8 年。反映到资本成本上,开发一个新药,平均耗资 13.95 亿美元,如果将资本时间成本和机会成本折算进去,这个数字为 25.58 亿美元。
但国内药企开发新药成本却要低得多,平均仅在 3 亿人民币左右。举例说明,恒瑞的吡咯替尼研发成本是 5.2 亿元,PD-1(报产)是 1.55 亿元,阿利沙坦酯也不到 3 亿元。
为何国内外新药研发成本差距如此之大?原因就在于两个字:风险。国内企业大都做的是 me-too 类药物,失败风险较低。从 ADC 药物均以 HER2 靶点开发可以看出这一点。
跟进式开发并不等于只有好处(低投入),同质化竞争会带来新的问题:后开发者的收益难以保证。
这从侧面说明了为何一个 Trop-2 靶点就能撑起 Immunomedics 公司的 210 亿美元估值。作为第一个上市的 Trop-2 靶点靶向药物,第一个吃螃蟹的人,公司承担的风险必然要折算到研发成本里;一旦成功,其收益也远非跟进式研发成果可比。
高风险,高收益,这是再简单不过的常识;更重要的是,Trodelvy 三期临床给出的初步数据乐观,已经足以折服吉利德。
仅仅是最近两年,FDA 已经批准上市了 5 个 ADC 药物。有观察者认为,这预示着生物制药公司从过去十年的临床试验经验中摸索出了解决 ADC 复杂设计难题的策略;吉利德的重磅交易更是把 ADC 的研发热度推向了高潮,这一重磅交易势必激励国内外更多生物公司进军 ADC 战场,靶向化疗大门已经开启。








 +61
+61 +86
+86 +886
+886 +852
+852 +853
+853 +64
+64


